Andehit là một ăn ý hóa học nhập vai trò cần thiết nhập cuộc sống và là nguyên vật liệu cho tới một trong những ngành công nghiệp. Vậy andehit là gì? Trong nội dung bài viết này, Monkey tiếp tục giúp cho bạn tổ hợp những kiến thức và kỹ năng vừa đủ và cụ thể nhất về andehit trải qua Điểm lưu ý cấu trúc, đặc thù, cơ hội pha chế và phần mềm của ăn ý hóa học này.
Định nghĩa Andehit là gì? Đặc điểm cấu trúc andehit
Anđehit là những hợp hóa học cơ học nhập phân tử với group –CH=O link với nguyên vẹn tử cacbon hoặc nguyên vẹn tử hidro. Nói cách tiếp theo, Andehit là thành phầm nhận được sau thời điểm nguyên vẹn tử H nhập hiđrocacbon được thay cho thế bởi group –CHO. Trong tình huống này, group –CH=O được gọi là group chức của Andehit.
Bạn đang xem: Andehit: Đặc điểm cấu tạo, tính chất, cách điều chế và ứng dụng
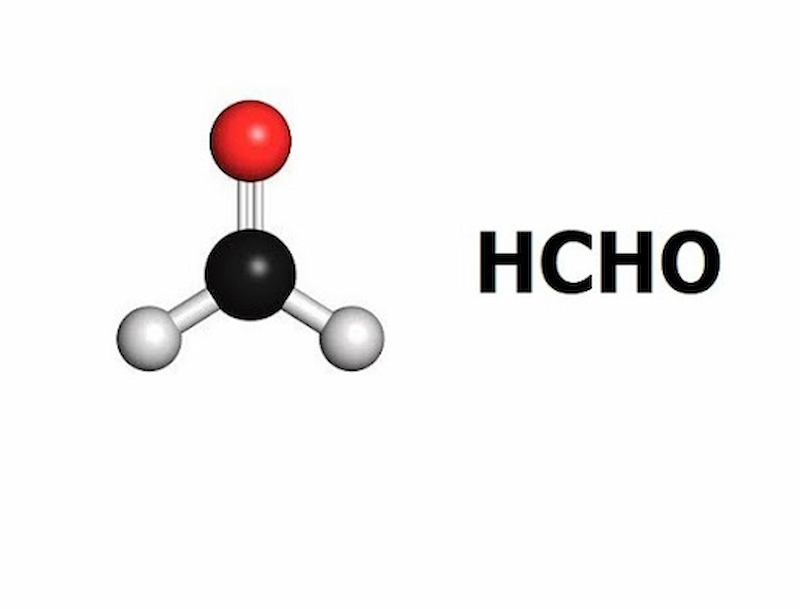
Một số ví dụ về Andehit:
- HCH=O: Anđehit Fomic hoặc Metanal.
- CH3CH=O: Anđehit Axetic hoặc Etanal.
- C6H5CH=O: Anđehit Benzoic hoặc Benzanđehit.
- O=CH-CH=O: Anđehit Oxalic
Công thức cấu trúc của Andehit:
Trong group -CHO, liên kết song C=O bao gồm một link σ bền và một link π kém cỏi bền lâu hơn, tương tự động link C=C nhập phân tử anken, vì thế anđehit với một trong những đặc thù cộng đồng tương đương anken.
Công thức andehit tổng quát:
-
CxHyOz: Trong ê, x, nó, z là số nguyên vẹn dương; nó là số chẵn vừa lòng ĐK 2 ≤ nó ≤ 2x + 2 – 2z và z ≤ x. Đây là công thức thông thường dùng để làm viết lách phản xạ cháy.
-
CxHy(CHO)z hoặc R(CHO)z: Công thức này thông thường được dùng để làm viết lách phản xạ xẩy ra nhập group CHO.
-
CnH2n+2-2k-z(CHO)z (với k = số link p + số vòng): Công thức này thông thường được sử dụng Khi viết lách phản xạ nằm trong H2 hoặc nằm trong Br2.
Phân loại anđehit
Dựa nhập Điểm lưu ý cấu trúc của gốc hidrocacbon và số group –CHO nhập phân tử, anđehit được phân thành 5 loại không giống nhau:
-
Andehit no, Andehit ko no và Andehit thơm phức (dựa nhập cấu trúc của gốc hidrocacbon).
-
Andehit đơn chức và Andehit nhiều chức (dựa nhập số group –CHO).
Ví dụ:
Anđehit no, mạch hở, đơn chức là ăn ý hóa học nhập phân tử có một group -CHO link với gốc ankyl hoặc nguyên vẹn tử hidro. Các hóa học H-CH=O, CH3-CH=O, CH3-CH2-CH=O... lập trở thành mặt hàng đồng đẳng andehit no, mạch hở, đơn chức với:
-
Công thức cấu trúc thu gọn: CxH(2x+1)-CHO (x>=0)
-
Công thức phân tử chung: CnH2nO (n>=1).
Công thức của Anđehit theo đòi từng phân loại trên:
-
Andehit no, đơn chức, mạch hở: CnH2n+1CHO (n≥0) hoặc CmH2mO (m≥1)
-
Andehit no, nhiều chức, mạch hở: CnH2n(CHO)2 (n≥0) hoặc CmH2m-2O2 (m≥2)
-
Andehit ko no, chứa chấp nối song C=C, đơn chức mạch hở: CmH2m-2O (m≥3)
Cách gọi thương hiệu anđehit
Tên gọi của một trong những anđehit thông thông thường = Andehit + thương hiệu axit ứng.
Tên thay cho thế của những andehit no, đơn chức, mạch hở = Tên hiđrocacbon no ứng với mạch chủ yếu + al. Trong số đó, mạch chủ yếu của phân tử anđehit là mạch cacbon nhiều năm nhất chính thức kể từ group -CHO.
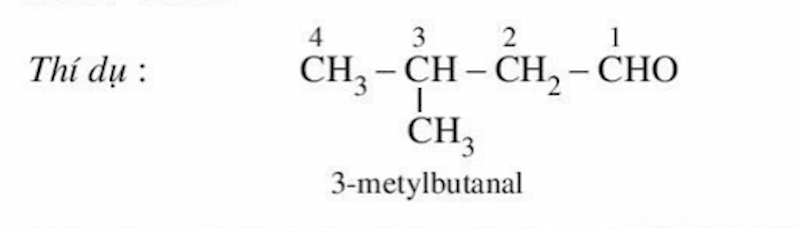
Cùng dò la hiểu danh pháp của một trong những Andehit no, đơn chức, mạch hở phổ cập nhập bảng sau:
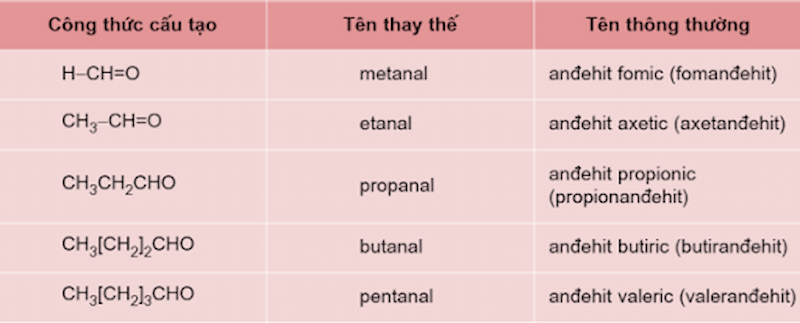
Ngoài đi ra, tất cả chúng ta cũng cần được cảnh báo tình huống đặc trưng nhập cơ hội gọi tên: Dung dịch HCHO 37% – 40% được gọi là fomalin hoặc fomon.
Tính hóa học vật lý cơ andehit
Andehit với tính gì? thì bên dưới đó là một trong những đặc thù vật lý cơ đặc thù của andehit mà bạn phải nhớ:

-
Trạng thái tồn tại: Tại ĐK thông thường, những anđehit mặt hàng đồng đẳng tồn bên trên bên dưới dạng hóa học khí (HCHO sôi ở -19 phỏng C và CH3CHO sôi ở nhiệt độ phỏng 21 phỏng C), tan rất tuyệt nội địa. Các anđehit tiếp theo sau là hóa học lỏng hoặc rắn, phỏng tan nội địa rời dần dần theo hướng tăng của phân tử khối.
-
Nhiệt phỏng sôi: Nhiệt phỏng sôi của Anđehit thấp rộng lớn Ancol nằm trong lượng bởi không tồn tại link hidro nhập phân tử và cao hơn nữa hidrocacbon với nằm trong số nguyên vẹn tử C.
-
Dung dịch nước của anđehit fomic là fomon.
-
Dung dịch bão hòa của anđehit fomic mật độ 37 - 40% là fomalin.
XÂY DỰNG NỀN TẢNG TOÁN HỌC VỮNG CHẮC CHO TRẺ TỪ NHỎ VỚI ĐA PHƯƠNG PHÁP DẠY HỌC TÍCH CỰC, CHI PHÍ CỰC RẺ CHƯA ĐẾN 2K/NGÀY CÙNG MONKEY MATH.
![]()
Tính hóa chất andehit
Tính hóa chất đặc thù của andehit Fe được thể hiện tại rõ rệt nhập phản xạ nằm trong hidro và phản xạ lão hóa ko trọn vẹn.
Phản ứng nằm trong hidro
Hiđro nằm trong nhập link song C=O tựa như nằm trong nhập link song C=C:
CH3-CH=O (anđehit axetic) + H2 → CH3-CH2-OH (ancol etylic) (Điều kiện: Nhiệt phỏng, xúc tác Ni)
Phản ứng tổng quát mắng như sau:
RCHO + H2 → RCH2OH (nhiệt phỏng, Ni xúc tác)
Như vậy, Khi phản xạ với H2, anđehit nhập vai trò là một trong hóa học lão hóa. Nếu gốc R với link π thì H2 tiếp tục nằm trong nhập những link π ê.
Phản ứng lão hóa ko trả toàn
Tiến hành thí nghiệm: Cho 1ml AgNO3 1% nhập ống thử, thêm thắt kể từ từ từng giọt hỗn hợp NH3, nhấp lên xuống đều cho tới Khi hỗn hợp nhập xuyên suốt. Tiếp tục thêm thắt vài ba giọt anđehit đun nhẹ nhàng vài ba phút nhập 60-70 phỏng C. Ta để ý thấy trở thành ống thử với một tấm bạc sắt kẽm kim loại màu tươi sáng.
Phản ứng như sau:
HCHO + 2AgNO3 + 3NH3 + H2O → H-COONH4 + 2Ag + 2NH4NO3 (nhiệt độ)
Phương trình tổng quát: R-CH=O + 2AgNO3 + 3NH3 + H2O → R-COONH4 + 2Ag + 2NH4NO3 (nhiệt độ)
Trong phản xạ này, ion Ag+ bị khử trở thành nguyên vẹn tử Ag với anđehit fomic là hóa học khử. Đây còn được gọi là phản xạ tráng bạc.
Như vậy, anđehit một vừa hai phải thể hiện tại tính lão hóa (anđehit fake trở thành axit cacboxylic tương ứng), một vừa hai phải thể hiện tại tính khử (anđehit fake trở thành ancol bậc I tương ứng).
Xem thêm:
- Phenol: Cấu tạo nên, đặc thù, cơ hội pha chế và những phần mềm phổ biến
- Xeton là gì? Tính hóa học, cơ hội pha chế và những phần mềm quan tiền trọng
Cách phân biệt andehit
Chúng tao rất có thể phân biệt andehit thông qua:
-
Khả năng andehit tạo nên kết tủa sáng loáng với AgNO3/ NH3.
-
Khả năng tạo nên trở thành kết tủa đỏ gay gạch ốp với Cu(OH)2 nhập nhiệt độ phỏng cao
-
Làm tổn thất màu sắc hỗn hợp nước brom. Trong ngôi trường phù hợp với HCHO, phản xạ nằm trong hỗn hợp brom sẽ có được khí CO2 bay đi ra.
2 cơ hội pha chế andehit
Andehit được pha chế như vậy nào? Cùng Monkey dò la hiểu 2 cơ hội pha chế andehit phổ biến:

Điều chế anđehit kể từ ancol
Oxi hóa ancol bậc I tao nhận được anđehit tương ứng:
R-CH2OH + CuO → R-CHO + H2O + Cu
Ví dụ: CH3-CH2OH + CuO → CH3-CHO + H2O + Cu (nhiệt độ)
Điều chế anđehit kể từ hidrocacbon
Trong công nghiệp, andehit được pha chế với 3 cách thức mái ấm yếu:
-
Oxi hóa metan với xúc tác nhập nhiệt độ phỏng 600-700 phỏng C, nhận được anđehit fomic:
CH4 + O2 → HCHO + H2O (nhiệt độ)
-
Oxi hóa trọn vẹn etilen, nhận được anđehit axetic:
2CH2=CH2 + O2 → 2CH3-CHO (nhiệt phỏng, xúc tác)
-
Phản ứng nằm trong nước kể từ axetilen:
CH-CH + H2O → CH3-CHO
4 phần mềm phổ cập của andehit
Andehit có nhiều phần mềm nhập cuộc sống, nhất là công nghiệp tạo ra. Một số phần mềm nổi trội của andehit rất có thể kể tới như:

-
Fomanđehit: Được dùng hầu hết nhập tạo ra vật liệu nhựa poli (phenol fomandehit) hoặc ure-fomanđehit, thực hiện hóa học mềm và sử dụng cho tới tổ hợp phẩm nhuộm, dược phẩm.
-
Fomalin: Dung dịch 37 -40% fomanđehit nội địa được gọi là fomalin, với phần mềm hầu hết nhập dìm xác động vật hoang dã, nằm trong domain authority hoặc tẩy uế, vô trùng,… Dung dịch nước của fomanđehit còn được dùng thực hiện hóa học tẩy uế, dìm kiểu động vật hoang dã thực hiện chi phí bạn dạng. Chúng với tính trị khuẩn nên còn được sử dụng nhập kỹ nghệ domain authority giầy.
-
Anđehit axetic: Được dùng để làm tạo ra axit axetic - nguyên vật liệu cho tới nhiều ngành tạo ra.
-
Anđehit thiên nhiên: Được dùng để nguyên liệu nhập công nghiệp đồ ăn, hóa mỹ phẩm như vanilin, piperonal, geranial (trong tinh chất dầu hoa hồng), xitrolenal (trong tinh chất dầu bạch đàn).
Bài tập dượt về Andehit axetic SGK kèm cặp điều giải chi tiết
Một số bài xích tập dượt về Andehit trang 203, 204 SGK Hóa học tập 11 tiếp sau đây tiếp tục giúp cho bạn hiểu ôn tập dượt thâm thúy những kiến thức và kỹ năng bên trên trải qua những cách thức giải hoặc, cộc gọn gàng.

Giải bài xích 2 SGK Hóa 11 trang 203
Viết những phương trình chất hóa học nhằm chứng minh rằng, anđehit một vừa hai phải với tính lão hóa một vừa hai phải với tính khử.
Gợi ý đáp án:
RCHO + H2 → RCH2OH (1) (nhiệt phỏng, xúc tác)
2RCHO + O2 → 2RCOOH (2) (nhiệt phỏng, xúc tác)
Trong (1), anđehit nhập vai trò là hóa học oxi hoá
Trong (2), anđehit nhập vai trò là hóa học khử.
Giải bài xích 3 SGK trang 203 Hóa 11
Hoàn trở thành mặt hàng fake hóa sau bởi những phương trình hóa học:
Metan → metyl clorua → metanol → metanal → axit fomic
Gợi ý đáp án:
Phương trình chất hóa học của mặt hàng fake hóa:
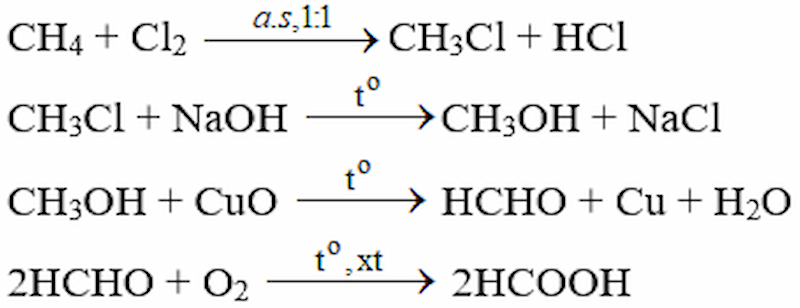
Giải bài xích 5 Hóa 11 SGK trang 203
Cho 50,0 gam hỗn hợp anđehit axetic thuộc tính với hỗn hợp AgNO3 nhập NH3 (đủ) nhận được 21,6 gam Ag kết tủa. Tính mật độ % của anđehit axetic nhập hỗn hợp đang được sử dụng.
Gợi ý đáp án:
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag↓ + 2NH4NO3
Từ phương trình tao có:
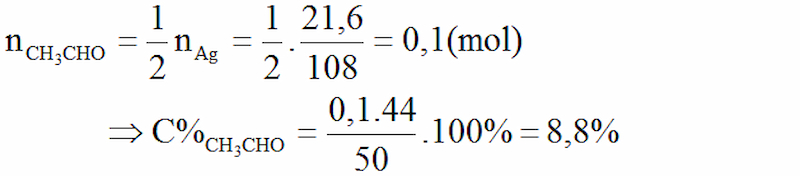
Giải bài xích 6 Hóa lớp 11 SGK trang 203
Ghi Đ (đúng) hoặc S (sai) nhập dù trống trải lân cận những câu sau:
a. Anđehit là ăn ý hóa học chỉ mất tính khử.
b. Anđehit nằm trong hidro tạo nên trở thành ancol bậc một.
c. Anđehit thuộc tính với hỗn hợp bạc nitrat nhập amoniac sinh đi ra bạc sắt kẽm kim loại.
d. Anđehit no, đơn chức, mạch hở với công thức phân tử tổng quát mắng CnH2nO.
e. Khi thuộc tính với hidro, xeton bị khử trở thành ancol bậc II.
Gợi ý đáp án:
a. Sai vì thế andehit với tất cả tính khử và tính oxi hóa
b. Đúng vì thế RCHO + H2 → RCH2OH
c. Đúng vì thế RCH=O + 2AgNO3 + H2O + 3NH3 → RCOONH4 + 2NH4NO3 + 2Ag
d. Đúng vì thế CTTQ của anđ no đơn chứa chấp mạch hở: CnH2nO
e. Đúng vì thế R1-CO-R2 + H2 → R1-CH(OH)-R2
Giải bài xích 7 Hóa Học lớp 11 SGK trang 203
Cho 8,0 gam láo lếu ăn ý nhì anđehit tiếp nối nhau nhập mặt hàng đồng đẳng của anđehit no, đơn chức, mạch hở thuộc tính với bạc nitrat nhập hỗn hợp ammoniac (lấy dư) nhận được 32,4 gam bạc kết tủa. Xác toan công thức phân tử, viết lách công thức cấu trúc và gọi thương hiệu những anđehit.
Gợi ý đáp án:
Trường ăn ý 1: Hai anđehit là HCHO và CH3CHO
Ta có:
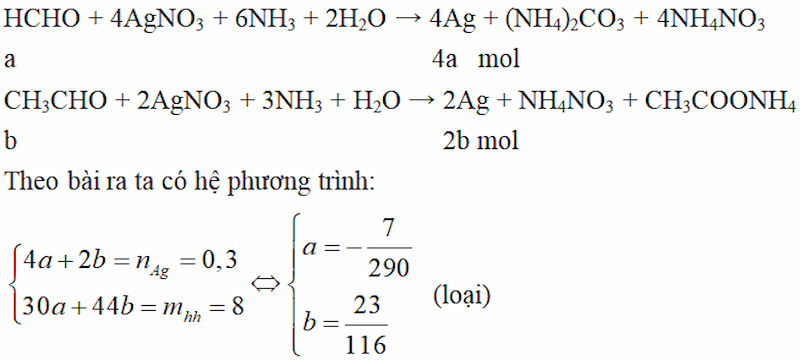
Trường ăn ý 2: Hỗn ăn ý nhì anđehit ko chứa chấp HCHO.
 ⇒ Hai anđehit là: CH3CHO (etanal) và C2H5CHO (etanal)
⇒ Hai anđehit là: CH3CHO (etanal) và C2H5CHO (etanal)
Bài tập dượt về andehit nhằm học viên tự động luyện
Bài 1: Đốt cháy trọn vẹn 10,8 gam một anđehit no, mạch hở nhớ dùng 10,08 lít khí O2 (đktc). Sản phẩm cháy cho tới qua loa hỗn hợp nước vôi nhập dư với 45 gam kết tủa tạo nên trở thành. Công thức phân tử của anđehit là gì?
Bài 2: Đốt cháy trọn vẹn 1 mol ăn ý hóa học cơ học X, nhận được 4 mol CO2. Chất X thuộc tính được với Na, nhập cuộc phản xạ tráng bạc và phản xạ cộng Br2 theo tỉ trọng mol 1 : 1. Tìm công thức cấu trúc của X.
Bài 3: Thể tích H2 (0∘C và 2 atm) một vừa hai phải đầy đủ nhằm thuộc tính với 11,2 gam anđehit acrylic là bao nhiêu?
Bài 4: Hiđro hóa trọn vẹn láo lếu ăn ý M bao gồm nhì anđehit X và Y no, đơn chức, mạch hở, tiếp nối nhau nhập mặt hàng đồng đẳng (MX<MY) nhận được láo lếu ăn ý 2 ancol với lượng to hơn lượng M là một gam. Đốt cháy trọn vẹn M nhận được 30,8 gam CO2. Tìm công thức phân tử và lượng xác suất của X.
Bài 5: Cho 7 gam hóa học A với CTPT C4H6O tác dụng với H2 dư với xúc tác tạo nên trở thành 5,92 gam ancol isobutylic. Tên của A là gì? Hiệu suất của phản xạ là bao nhiêu?
Bài 6: Hỗn ăn ý A bao gồm anđehit acrylic và một anđehit đơn chức X. Đốt cháy trọn vẹn 19,04 gam láo lếu ăn ý bên trên cần thiết một vừa hai phải không còn 29,792 lít khí oxi (đktc). Cho toàn cỗ thành phầm cháy hít vào không còn nhập dung dịch Ca(OH)_2Ca(OH)2 dư, nhận được 104 gam kết tủa. Công thức cấu trúc thu gọn gàng của X là gì?
Bài 7: Oxi hóa ko trọn vẹn 4,6 gam một ancol no, đơn chức bằng CuOCuO đun rét nhận được 6,2 gam láo lếu ăn ý X bao gồm anđehit, nước và ancol dư. Cho toàn cỗ láo lếu ăn ý X phản xạ trọn vẹn với lượng dư dung dịch AgNO_3AgNO3 trong NH_3NH3 đun rét nhận được m gam AgAg. Giá trị của m là bao nhiêu?
Bài 8: Một láo lếu ăn ý X bao gồm axetilen, anđehit fomic, axit fomic và H_2H2. Lấy z mol láo lếu ăn ý X cho tới qua NiNi, nhóm rét nhận được láo lếu ăn ý Y bao gồm những hóa học cơ học và H_2H2. Đốt cháy trọn vẹn láo lếu ăn ý Y rồi hít vào không còn thành phầm cháy bởi nước vôi nhập dư, sau thời điểm những phản xạ xẩy ra trọn vẹn nhận được 15 gam kết tủa và lượng hỗn hợp nước vôi rời 3,9 gam. Giá trị của z là bao nhiêu?
Xem thêm: Tuổi Tỵ 2001 là mệnh gì, hợp tuổi nào?
Bài 9: Hỗn ăn ý X bao gồm anđehit axetic, axit butiric, etilen glicol và axit axetic nhập ê axit axetic lúc lắc 27,13% lượng láo lếu ăn ý. Đốt 15,48 gam láo lếu ăn ý X nhận được V lít CO_2CO2 (đktc) và 11,88 gam H_2OH2O. Hấp thụ V lít CO_2CO2 (đktc) nhập 400 ml dd NaOHNaOH x mol/l nhận được hỗn hợp Y chứa chấp 54,28 gam hóa học tan. Giá trị của x là bao nhiêu?
Bài 10: Hiđro hoá trọn vẹn láo lếu ăn ý M bao gồm nhì anđehit X và Y no, đơn chức, mạch hở, tiếp nối nhau nhập mặt hàng đồng đẳng (M_XMX < M_YMY), nhận được láo lếu ăn ý nhì ancol với lượng to hơn lượng M là một gam. Đốt cháy trọn vẹn M nhận được 30,8 gam CO_2CO2. Công thức và xác suất lượng của X theo lần lượt là bao nhiêu?
Hy vọng nội dung bài viết bên trên trên đây đang được hỗ trợ cho mình hiểu những kiến thức và kỹ năng cơ bạn dạng cần thiết nhất về andehit. Monkey hòng rằng, những vấn đề này tiếp tục giúp cho bạn nắm rõ rộng lớn về andehit và rất có thể vận dụng thành thục những kiến thức và kỹ năng này trong những dạng bài xích tập dượt Hóa học tập giống như thực tiễn đưa cuộc sống. CLICK “NHẬN CẬP NHẬT” ở đầu trang nhằm ko bỏ qua những bài học kinh nghiệm thú vị về môn Hóa học tập khác!











Bình luận