Ôn luyện môn Hóa học tập 10
Cách tính mdd sau phản xạ được Shop chúng tôi thuế tầm và tổng phải chăng thuyết nhập lịch trình giảng dạy dỗ. Nội dung tư liệu sẽ hỗ trợ chúng ta học viên học tập đảm bảo chất lượng môn Hóa học tập lớp 10 hiệu suất cao rộng lớn. Mời chúng ta xem thêm.
Bạn đang xem: Cách tính mdd sau phản ứng
Cách tính mdd sau phản ứng:
Tính lượng hỗn hợp sau thời điểm nhập cuộc phản xạ theo gót công thức:
m dd = lượng những hóa học tan mang đến nhập hỗn hợp + lượng hỗn hợp – lượng của hóa học kết tủa – lượng của hóa học khí.
Cách tính lượng dung dịch
Ví dụ: Cho biết phương pháp tính lượng dung dịch?
Trả lời:
Các phương pháp tính lượng của dung dịch:
Cách 1: Tính lượng hỗn hợp lúc biết lượng hóa học tan và lượng dung môi.
mdd = mct + mdm
Trong đó:
+ mdd là lượng hỗn hợp (g).
+ mct là lượng hóa học tan (g).
+ mdm là lượng dung môi (g).
Ví dụ: Hòa tan 10 g muối bột NaCl nhập 40 gam nước. Tính độ đậm đặc Phần Trăm hỗn hợp muối bột chiếm được.
Giải
Theo đề bài bác tớ có: mct = 10 g, mdm = 40 g
Khối lượng hỗn hợp muối bột là: mdd = mct + mdm = 10 + 40 = 50 g
Nồng phỏng Phần Trăm hỗn hợp muối bột thu được:
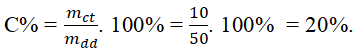
Cách 2: Tính lượng hỗn hợp lúc biết lượng hóa học tan đem nhập hỗn hợp và độ đậm đặc Phần Trăm của hỗn hợp.
![]()
Trong đó:
+ mdd là lượng hỗn hợp (g)
+ mct là lượng hóa học tan đem nhập hỗn hợp (g).
+ C% là độ đậm đặc % của hỗn hợp.
Cách 3: Tính lượng hỗn hợp lúc biết lượng riêng biệt và thể tích hỗn hợp.
Xem thêm: 101 mẫu hình ảnh chúc ngày mới cho người yêu đẹp nhất đẹp nhất, chất lượng cao, tải miễn phí
mdd = Vdd.d
Trong đó:
+ mdd là lượng hỗn hợp (g)
+ Vdd là thể tích hỗn hợp (ml)
+ d là lượng riêng biệt của hỗn hợp (g/ml)
Ví dụ:
Tính lượng của 100 ml hỗn hợp H2SO4, biết lượng riêng biệt của hỗn hợp là d = 1,83 g/ml.
Hướng dẫn:
Khối lượng hỗn hợp là:
mdd = Vdd.d = 100.1,83 = 183 g.
Dạng 1: Bài luyện về tính chất độ đậm đặc Phần Trăm, lượng hóa học tan, lượng hỗn hợp, lượng dung môi
Học sinh cần thiết ghi ghi nhớ những công thức cơ bạn dạng về độ đậm đặc Phần Trăm, lượng hóa học tan, lượng hỗn hợp, kể từ tê liệt mới mẻ hoàn toàn có thể áp dụng thuần thục nhập thực hiện bài bác luyện.

Ngoài rời khỏi, học viên cần thiết nắm rõ phương pháp tính lượng hỗn hợp sau phản xạ nhằm dò thám rời khỏi thành quả đúng đắn nhất. Khi tính lượng hỗn hợp sau phản xạ, học viên cần thiết ghi ghi nhớ những tình huống bên dưới đây:

Dạng tính độ đậm đặc Phần Trăm của hỗn hợp

Dạng tính lượng hóa học tan nhập dung dịch

Dạng tính lượng hỗn hợp, lượng dung môi

Dạng 2: Bài luyện tổ hợp về độ đậm đặc %

Dạng 3: Bài thói quen độ đậm đặc mol, số mol hóa học tan, thể tích dung dịch

Dạng tính độ đậm đặc mol của dung dịch

Dạng 4: Bài luyện tổ hợp về độ đậm đặc mol

----------------------------------------
Trên trên đây VnDoc đang được reviews cho tới chúng ta nội dung bài bác Cách tính mdd sau phản xạ. Để đem thành quả học hành đảm bảo chất lượng và hiệu suất cao rộng lớn, VnDoc van reviews cho tới chúng ta học viên tư liệu Giải bài bác luyện Hóa học tập 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học tập 10, Giải bài bác luyện Toán 10. Tài liệu học hành lớp 10 tuy nhiên VnDoc tổ hợp biên soạn và đăng lên.










Bình luận